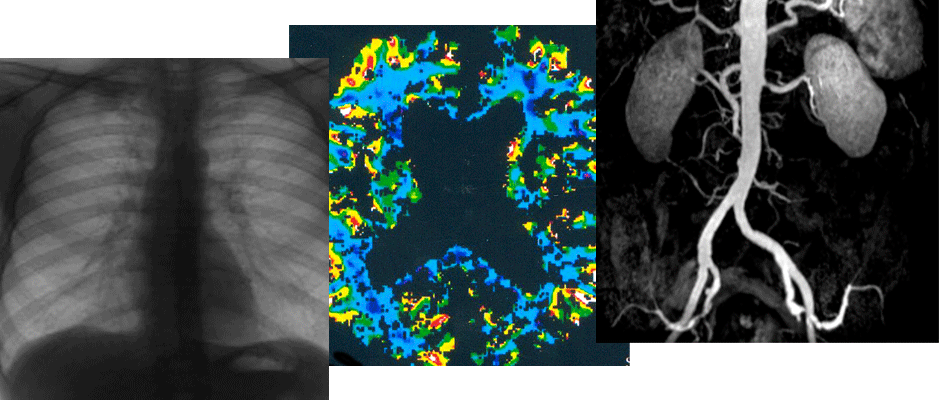
Аннотация: Цель: проанализировать отдаленные результаты полного восстановления истинного просвета аорты при осложненных диссекциях типа В с применением баллон-расширяемых стентов под контролем внутрисосудистого ультразвукового исследования (ВСУЗИ) для интраоперационной оценки анатомии и морфологии поражений. Материалы и методы: 47 пациентов были пролечены в нашем отделении по поводу диссекции аорты типа В. В 20 случаях вмешательства выполняли под контролем внутриаортального ультразвукового исследования. У 16 пациентов развились осложнения диссекции типа В,потребовавшие восстановления истинного просвета аорты на всем протяжении, путем перекрытия проксимальной фенестрации стент-графтом с последующей установкой непокрытых металлических баллоннорасширяемых стентов, под контролем внутриаортального ультразвукового исследования на каждом этапе вмешательства. Среди 16 пациентов, подвергнутых продолженному стентированию аорты, 87,5% были мужчины, средний возраст этой группы больных составил 51,8±16,2 лет Результаты: технический успех вмешательств составил 100%. Полное восстановление истинного просвета достигнуто во всех случаях под контролем внутрисосудистого ультразвука. Нарушений кровотока по висцеральным артериям не было зафиксировано ни за период госпитализации, ни за весь период наблюдения. Уровень 30-дневной смертности составил 6,25% - один пациент скончался через 7 дней после операции в результате разрыва стенки аорты на оставшемся непокрытым участке. Все 15 выписанных пациентов были живы в течение года после вмешательства. Срок наблюдения составляет 3,3± 1,6 лет В отдаленном периоде наблюдения один пациент скончался в результате формирования аорто-легочной фистулы, 1 от последствий повторного ишемического инсульта и 1 в результате онкологического заболевания. По данным МСКТ через 2 года после установки баллон-расширяемых стентов отмечается поломка их ячеек, без сужения просвета или утолщения аортальной стенки. Размер истинного просвета оставался стабильным на протяжении 1 года наблюдения. Заключение: активное восстановление истинного просвета аорты под контролем внутриаортального ультразвукового исследования является приемлемым методом для пациентов с осложненной диссекцией типа В, даже при применении баллон-расширяемых стентов. Применение внутрисосудистого ультразвукового исследования является определяющим моментом развития сложных эндоваскулярных вмешательств. Список литературы 1. Erbel R., Aboyans V., Boileau C., et al. Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and treatment of aortic diseases: document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. Eur Heart J. 2014;35:2873-926. 2. Fattori R., Cao P., De Rango P, et al. Interdisciplinary expert consensus document on management of type B aortic dissection. J Am Coll Cardiol. 2013; 61: 1661-78. 3. Eggebrecht H., Nienaber C.A., Neuhauser M., et al. Endovascular stent graft placement in aortic dissection: a metaanalysis. Eur Heart J. 2006; 27: 489e98. 4. Mossop P.J., McLachlan C.S., Amukotuwa S.A., Nixon I.K. Staged endovascular treatment for complicated type B aortic dissection. Nat Clin Pract Cardiovasc Med. 2005;2:316-21. 5. Canaud L., Faure E.M., Ozdemir B.A., Alric P., Thompson M. (2014) Systematic review of outcomes of combined proximal stent-grafting with distal bare stenting for management of aortic dissection. Ann Cardiothorac Surg. 3: 223-233. 6. Nienaber C.A., von Kodolitsch Y, Nicolas V., et al. The diagnosis of thoracic aortic dissection by noninvasive imaging procedures. N Engl J Med. 1993; 328: 1-9. 7. Evangelista A., Flachskampf F.A., Erbel R., et al. Echocardiography in aortic diseases: EAE recommendations for clinical practice. Eur J Echocardiogr. 2010; 11: 645-658. 8. Fattori R., Caldarera I., Rapezzi C., et al. Primary endoleakage in endovascular treatment of the thoracic aorta: importance of intraoperative transesophageal echocardiography. J Thorac Cardiovasc Surg. 2000; 120: 490-5. 9. Rocchi G., Lofiego C., Bigini E., et al. Transesophageal echocardiography-guided algorithm for stent-graft implantation in aortic dissection. J Vasc Surg. 2004; 40: 880-5. 10. Morton J.B., Sanders P., Sparks P.B., et al. Usefulness of phased-array intracardiac echocardiography for the assessment of left atrial mechanical “stunning” in atrial flutter and comparison with multiplane transesophageal echocardiography. Am J Cardiol. 2002; 90: 741-6. 11. Marrouche N.F., Martin D.O., Wazni O., et al. Phased-array intracardiac echocardiography monitoring during pulmonary vein isolation in patients with atrial fibrillation: impact on outcome and complications. Circ 2003; 107: 2710-6. 12. Caldararu C., Balanescu S. Modern Use of Echocardiography in Transcatheter Aortic Valve Replacement: an Up-Date. M&dica. 2016; 11(4): 299-307. 13. Jongbloed MR.M., Schalij M.J., Zeppenfeld K., et al.Clinical applications of intracardiac echocardiography in interventional procedures. Heart. 2005; 91(7): 981-990. doi:10.1136/hrt.2004.050443. 14. Kang S.J., Ahn J.M., Kim W.J., et al. Intravascular ultrasound assessment of drug-eluting stent coverage of the coronary ostium and effect on outcomes. Am J Cardiol. 2013; 111: 1401-7. 15. Hitchner E., Zayed M.A., Lee G., et al. Intravascular ultrasound as a clinical adjunct for carotid plaque characterization. J Vasc Surg 2014; 59: 774-80. 16. Diethrich E.B., Irshad K., Reid D.B. Virtual histology and color intravascular ultrasound in peripheral interventions. Semin Vasc Surg. 2006; 19: 155-62. 17. Song T.K., Donayre C.E., Kopchok G.E., White R.A. Intravascular ultrasound use in the treatment of thoracoabdominal dissections, aneurysms, and transections. Semin Vasc Surg. 2006; 19: 145 9. 18. Pearce B.J., Jordan W.D. Jr. Using IVUS during EVAR and TEVAR: Improving patient outcomes. Semin Vasc Surg. 2009; 22: 172 80. 19. Lee J.T., White R.A. Basics of intravascular ultrasound: An essential tool for the endovascular surgeon. Semin Vasc Surg. 2004; 17: 110 8. 20. Гольдина И.М., Трофимова Е.Ю., Коков Л.С., Пархоменко М.В., Черная Н.Р., Соколов В.В., Редкобородый А.В., Рубцов Н.В. Возможности внутрисосудистого ультразвукового исследования с использованием катетерного датчика с фазированной решеткой в диагностике и лечении расслоения аорты. Ультразвуковая и функциональная диагностика. 2016; 1: 78-89. 21. Martin Z.L., Mastracci T.M. The evaluation of aortic dissections with intravascular ultrasonography. Vascular Disease Management. 2011; 03(31). Available at: http://www.vasculardiseasemanagement.com/content/ev aluation-aortic-dissections-intravascular-ultrasonography/ (accessed 10 march 2018). 22. Eggebrecht H., Nienaber C.A., Neuhauser M., et al. Endovascular stent graft placement in aortic dissection: a metaanalysis. Eur Heart J. 2006; 27: 489e98. 23. Mossop P.J., McLachlan C.S., Amukotuwa S.A., Nixon I.K. Staged endovascular treatment for complicated type B aortic dissection. Nat Clin Pract Cardiovasc Med. 2005; 2: 316e22. 24. Nienaber C.A., Kische S., Zeller T., et al. Provisional extension to induce complete attachment after stent graft placement in type B aortic dissection: the PETTICOAT concept. J Endovasc Ther. 2006; 13: 738e46. 25. Lombardi J.V., Cambria R.P, Nienaber C.A., et al. Prospective multicenter clinical trial (STABLE) on the endovascular treatment of complicated type B aortic dissection using a composite device design. J Vasc Surg. 2012; 55: 629e40. 26. Hoshina K., Kato M., Miyahara T., et al. Retrospective study of intravascular ultrasound use in patients undergoing endovascular aneurysm repair: Its usefulness and a description of the procedure. Eur J Vasc Endovasc Surg. 2010; 40: 559-63. 27. Guo B-L., Shi Z-Y, Guo D-Q., et al. Effect of Intravascular Ultrasound-assisted Thoracic Endovascular Aortic Repair for «Complicated» Type B Aortic Dissection. Chinese Medical Journal. 2015; 128(17): 2322-2329.
Аннотация: В многоцентровое исследование на ретроспективной основе было включено 201 2 больных для определения эффективности различных методик лечения больных с рестенозами коронарных артерий после стентирования. Рассчитанная средняя частота осложнений после вмешательств по поводу рестенозов стентов за период 1 1 ±4 месяцев наблюдения составила 20%. Анализ данных с помощью метода метарегрессии выявил достоверную положительную корреляцию между степенью резидуального стеноза стентированного сосудистого сегмента после вмешательства и возможностью развития осложнений: с уменьшением степени резидуального стеноза на 1%, частота развития осложнений снижалась, приблизительно, на 0,9%. Все другие анализируемые факторы не обладали достоверным влиянием, однако. Отмечена тенденция к лучшим результатам повторных вмешательств при возрастании диаметра сосуда.Повторная баллонная ангиопластика при развитии коротких рестенозов стентов и интракоронарное облучение в случаях диффузных рестенотических поражений являются наиболее эффективными вмешательствами. Показания к имплантации дополнительных стентов должны определяться с осторожностью, особенно у больных с сахарным диабетом. Список литературы 1. Fischman D.L., Leon M.D., Baim D.S., et al. A randomized comparison of coronary stent placement and balloon angioplasty in treatment of coronary artery disease. N. Engl. J. Med. 1994; 331: 496 - 501. 2. Serruys P.W, de Jaeger P., Kimeneij E, et al. A comparison of balloon-expandable stent implantation with balloon angioplasty in patients with coronary heart disease. N. Engl]. Med. 1994; 331: 489 - 495. 3. Di Mario C, Marsico E, Adamian M. et al. New recipes for in-stent restenosis: cut, grate, roast, or sandwich the neointima? Heart. 2000; 84: 471 - 475. 4. Hoffmann R., Mintz G. S. Coronary in-stent restenosis-predictors, treatment and prevention. Eur. Heart J. 2000; 21: 1739- 1749. 5. Leon M.B., Tierstein P.S., Moses J.W et al. Localized intracoronary gamma-radiation therapy to inhibit the occurrence of restenosis after stenting. N. Egl. J. Med. 2001; 344: 250-256. 6. Waksman R., White R.L., Chan R.C., et al. Intracoronary gamma-radiation therapy after angioplasty inhibits reccurence in patients with in-stent restenosis. Circulation. 2000; 101: 2165 - 2171. 7. Sousa J. E., Costa M.A., Abizaid A., et al. Lack of neoitimal proliferation after implantation of sirolimus-coated stents in human coronary arteries: a quantitative coronary angiography and three-dimensional intravascular ultrasound study. Circulation. 2001; 10: 192 - 195. 8. Kuntz R.E., Gibson СМ., Nobuyoshi M., et al. Generalized model of restenosis after conventional balloon angioplasty, stenting and directional atherectomy. J. Am. Coll. Cardiology. 1993; 21: 15 - 25.
Аннотация: Постинфарктный разрыв межжелудочковой перегородки (МЖП) - одно из наиболее редких и летальных осложнений острого инфаркта миокарда (ОИМ). Представляется клинический случай реканализации дефекта МЖП (ДМЖП) через 7 месяца после хирургического вмешательства. Учитывая высокий риск повторной операции принято решение об эндоваскулярной окклюзии ДМЖП. Во время процедуры имплантации окклюдера, несмотря на удовлетворительный тест на стабильность, после отсоединения системы доставки произошла миграция устройства в полость левого желудочка. Извлечь окклюдер не удалось из-за фиксации одного из дисков в хордальном аппарате створки митрального клапана. Наличие 12 мм окклюдера под створкой не усугубило степень митральной недостаточности, не ограничивало подвижность створки, на этом основании принято решение оставить устройство и закончить процедуру коррекции ДМЖП имплантацией окклюдера большего диаметра. Окклюдер диаметром 14 мм был успешно имплантирован со значительной редукцией лево-правого сброса и снижением давления в легочной артерии до нормального уровня на операционном столе. Период наблюдения составляет 3 года - пациентка удовлетворительно себя чувствует Фракция выброса составляет 55%, митральная недостаточность 30% по объему, устройство полностью эндотелизировано. Эндоваскулярная окклюзия реканализованного ДМЖП является эффективной методикой. В ситуации миграции устройства необходим тщательный функциональный анализ для определения наилучшей тактики ведения пациента. В данной клинической ситуации решение не извлекать окклюдер не повлекло неблагоприятных последствий для пациентки. Список литературы 1. Koh A.S., Loh YJ., Lim YP., Le Tan J. Ventricular septal rupture following acute myocardial infarction. Acta Cardiol. 2011;66(2):225-30. 2. Crenshaw B.S., Granger C.B., Birnbaum Y et al. Risk factors, angiographic patterns, and outcomes in patients with ventricular septal defect complicating acute myocardial infarction (GUSTO-I (Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries) Trial Investigators). Circulation. 2000;101:27-32. 3. Serpytis P, Karvelyte N., Serpytis R. et al. Postinfarction ventricular septal defect: risk factors and early outcomes. Hellenic J Cardiol. 2015;56(1):66-71. 4. Arnaoutakis G.J., Zhao Y, George T.J. et al. Surgical repair of ventricular septal defect after myocardial infarction: outcomes from the Society of Thoracic Surgeons National Database. Ann Thorac Surg. 2012; 94:436-443. 5. Assenza G.E., McElhinney D.B., Valente A.M. et al. Transcatheter closure of post-myocardial infarction ventricular septal rupture. Circ Cardiovasc Interv. 2013;6:59-67. 6. Calvert PA., Cockburn J., Wynne D. et al. Percutaneous closure of postinfarction ventricular septal defect: in-hospital outcomes and long-term follow-up of UK experience. Circulation. 2014;129:2395-402. 7. Deja M.A., Szostek J., Widenka K. et al. Post infarction ventricular septal defect - can we do better? Eur J Cardiothorac Surg. 2000;18:194-201. 8. Takahashi H., Arif R., Almashhoor A., et al. Longterm results after surgical treatment of postinfarction ventricular septal rupture. Eur J Cardiothorac Surg. 2015;47(4):720-724. 9. Holzer R., Balzer D., Lock Qi-Ling Cao K., Hijazi Z.M. Device closure of muscular ventricular septal defects using the Amplatzer muscular ventricular septal defect occluder. J Am Coll Cardiol. 2004;43:1257-1263.